Радиоактивные вещества и колотые раны.
Авторы: И.К. Беляев, Е.С. Жорова, B.C. Калистратова, П.Г. Нисимов, И.М. Парфенова, Г.С. Тищенко, В.Н. Яценко.
Введение
Раневой путь поступления радиоактивных веществ в организм наряду с ингаляционным - основной для производственных и лабораторных условий.
Случаи раневых поступлений актинидов зарегистрированы у сотен и тысяч лиц из числа персонала плутониевых производств как в России [17,23,44,49], так и за рубежом [41,43,45,46,52-54,56-58,60-62].
У персонала заводов и производств в Sellafield (Великобритания) зафиксировано 1 250 радиоактивных загрязнений повреждённых кожных покровов [64], в Rocky Flats (США) - 300 подобных случаев [37], в Hanford (США) - 136 ранений кожи, загрязнённых плутонием [39], на ПО «Маяк» - у 5% персонала загрязнения - излучающими радионуклидами сопровождались травмами кожи кистей рук [23], зарегистрировано 297 человек, у которых отмечено 385 инцидентов [25].
Ранения кожи зарегистрированы у 15% (у 133 из 888) обследованных работников Сибирского химического комбината - носителей плутония. Содержание радионуклида в их организме оказалось в 6,2 раза выше, чем у не имеющих травм. При содержании в организме плутония свыше 740 Бк, что зафиксировано в историях болезней, травмы кожи зарегистрированы у 40% работников [17].
Из 385 случаев ранений кожи, зарегистрированных с конца 1940-х по 1 января 2010 года на ПО «Маяк» [25], 74% и 16% повреждений - колотые и резаные раны кожи, 10% - химические ожоги, рваные раны, ссадины. Среди мест ранений - голова, плечи, живот, ягодицы, ноги и т.д. 97 % случаев приходилось на кисти рук. Повреждения правой и левой кисти встречались с одинаковой частотой. Около трети травм кожи кистей рук — повреждения указательных пальцев. В Лос-Аламосской лаборатории с 1960 по 1972 г.г. травмы работников, загрязненные трансурановыми элементами в 83% случаев локализованы в области пальцев и кистей рук [44].
Биокинетические модели обмена радионуклидов в колотой ране
Многообразие процессов, определяющих поведение плутония и других многозарядных катионов в ранах, иллюстрирует схема обмена элемента, предложенная в 1969 г. Schofield [67] (Рис. 1а).
Клиренс плутония из места ранения в значительной степени осуществляется посредством системы кровообращения [4,12] в виде комплексных соединений и в форме, связанной с протеинами. Многозарядные катионы тяжелых элементов образуют с белками тем более прочные, труднодиссоциирующие соединения, чем больше заряд и радиус катионов [2].
Радиоколлоидные частицы не диффундируют через стенку кровеносных капилляров с нормальной проницаемостью. Коллоидальная фракция (включая и нерастворимые частицы) поступает из раны в организм лимфатическим путем в результате «постепенного растворения» [4]. Вследствие фагоцитоза коллоидов, радионуклиды задерживаются в лимфатических узлах. При введении в лапы собак раствора азотнокислого или частиц (25 мкм) диоксида 239Pu его выведение происходит из места первоначального отложения в лимфатические узлы, дренирующие место ранения [28,30,31,43]. Количество плутония в региональных лимфатических узлах поросят через 1 и 7 суток после внутрикожного введения азотнокислого 239Pu достигает 4,5 и 12%, соответственно [29]. При подкожном или внутримышечном введении нитрата 239Pu в лапы крыс через неделю после инъекции 11 % от введённого количества найдено в плечевых и пазушных лимфатических узлах [40]. Перемещение в лимфоузлы нитрата 239Pu происходит быстрее, чем оксида [30,43]. Всасывание мелкодисперсных коллоидов PuO2 из подкожной клетчатки возможно и через кровеносные капилляры [42,43].
Склонность плутония к гидролизу зависит от размера и заряда иона и уменьшается в порядке Pu4+>PuO22+>Pu3+>PuO2+. При введении в мышечную или подкожную ткань соединения плутония гидролизуются (pH среды в организме ~ 7,36). При крайне малых значениях концентраций радионуклидов в растворе из-за непревышения произведений растворимости коллоидные осадки могут не образовываться [2]. При концентрации 6,8x10-8 М весь плутоний будет находиться в ионном состоянии [4]. Радионуклиды, введенные в микроконцентрациях, оказываются в тканях в виде катионов, что сопровождается их высокой резорбцией.
Камерная модель переноса радионуклидов из раны, опубликованная в 1989 г. Piechowski и соавт. (Рис. 1б), рассматривает три пути их выведения из места ранения [60]. В модели: Q1, — доля, долго удерживаемая в месте первоначального отложения радионуклида доля, Q2 — доля, перемещающаяся в кровь через повреждённые сосуды с периодом полувыведения из камеры 0,01 суток, Q3—доля, перемещающаяся с промежуточной скоростью в мягкие ткани (мышцы, соединительные ткани, и т.д.), откуда поступает в кровь или непосредственно, или через лимфатическую систему.
В 2007 г. в публикации №156 Национального совета по радиационной защите и измерениям США представлена наиболее полно проработанная под руководством Guilmette и Durbin биокинетическая модель обмена радионуклидов в месте ранения (Рис. 1в) [32].
Рис. 1.
- (а) - схема распространения Рu из раны [Schofield и соавт. - 67];
- (б) - камерная модель переноса радионуклидов из загрязнённой раны [Piechowski и соавт. — 63];
- (в) - структурная схема биокинетической модели обмена радионуклидов в месте ранения. [32]
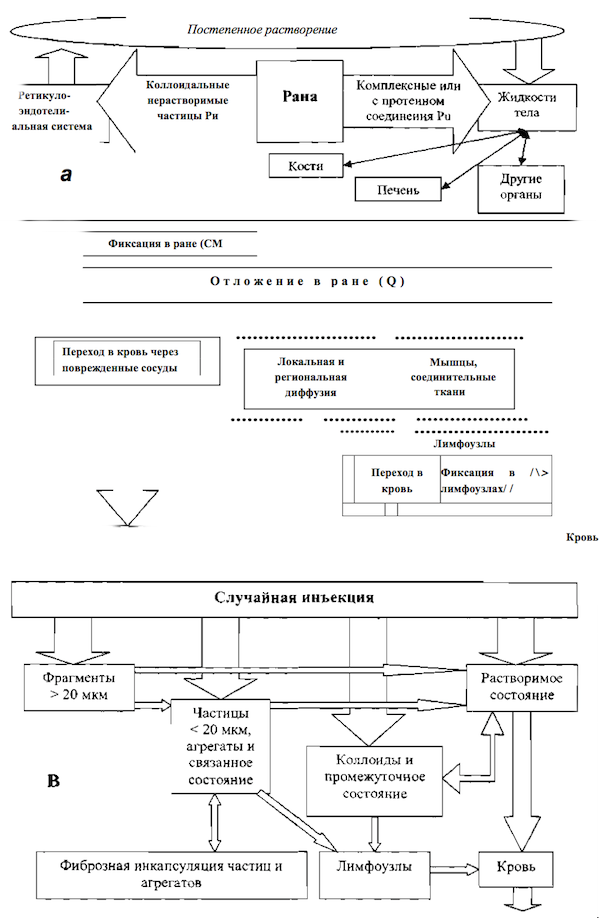 |
Радиоактивный материал, поступающий в рану, классифицирован на 4 типа. Это — фрагменты (крупные осколки) — твёрдые материалы с размером частиц >20 мкм (металлические плутониевые заусенцы, загрязнённые радионуклидами осколки стекла, нерадиоактивного металла и т.д.), которые слишком велики для перемещения фагоцитами; частицы твердых материалов < 20 мкм, которые могут быть захвачены макрофагами; коллоиды и полимерные гидроксиды; растворимые соединения. Для растворимых соединений радионуклидов введены 4 вида их удержания в ране, классификация которых основана на долях радионуклида (% от первоначального отложения), остающихся в месте ранения через сутки и через несколько недель после поступления радиоактивного материала. Слабое, умеренное, сильное и сверхсильное удержание радионуклидов в количестве — 14, 7, 21 и 6, соответственно (Табл. 1).
При ранении может происходить поступление любой из этих форм или их различные комбинации. Модель, не делая различий в поведении радионуклидов, загрязняющих места колотых ранений, ссадин, рваных ран или ожогов, признает, что биокинетику радионуклида будет определять характер и глубина повреждения тканей.
Межвидовая экстраполяция данных раневого поступления радионуклидов
Основным и обязательным условием корректности экстраполяции на человека данных о раневом поступлении, метаболизме и биологическом действии радиоактивных веществ у животных является адекватность исследовательской модели практическим, реальным ситуациям - глубине проникновения радионуклида и его исходному физико-химическому состоянию.
Основная функция многослойного кожного покрова тела млекопитающих — защитная, в том числе - препятствие проникновению во внутреннюю среду организма радиоактивных веществ.
Водно-жировая пленка кожи - первый слой защитного покрова. Органические и минеральные соединения, входящие в состав пленки определяют её комплексообразующие и сорбционные свойства в связывании радиоизотопов на поверхности [9].
Эпидермис (поверхностный, эпителиальный слой) и дерма (глубжележащий, соединительнотканный слой), состоящая из сосочкового и сетчатого слоев, разделенных базальной мембраной, образуют собственно кожу [18,26]. Подкожная клетчатка тесно связана с кожей. Во многих местах гиподерма переходит в подкожную жировую ткань и рядом авторов рассматривается как третий слой кожи [14,23].
Таблица 1. Классификация радиоактивных материалов, поступающих в раны [32]
|
Нерастворимые: |
||
|
Фрагменты > 20 мкм |
Частицы < 20 мкм |
Коллоиды и полимерные гидроксиды |
|
Растворимые: |
||
|
Удержание в ране |
Радионуклиды |
% от введенного количества через 1/16 или 64* суток после ранения |
|
Слабое |
Щелочные (I) и щелочноземельные (II) металлы, ионы Сu, уранила, оксо- и хлор- анион, анионные (I) формы йода |
<10/<3 |
|
Умеренное |
110Ag+, 223Ra2+, 48VO3-, 105RhC163-, 127mTeO42-, 193PtC142- и 188OsO52- |
11÷55/<5* |
|
Сильное |
Почти все III-валентные (241Аm3+), часть II-валентных, 238Рu (IV), 239Рu (не более 3,2 мг) |
32÷85 / 8÷40* |
|
Сверхсильное |
46Sc3+, 95Zr4+, 113Sn4+, 233Pa5+ и 238, 234Th4+ |
>80/> 50* |
Рис 2. Тетрадекаэдрическая «упаковка» клеток эпидермиса:
- (а) — вертикальные колонки клеток рогового слоя, сцепленные с клетками соседних колонок Ув. х650;
- (б) — модель «упаковки» уплощенных тетрадекаэдрических клеток рогового слоя в колонки;
- (в) — сцепленные шестиугольные контуры клеток зернистого слоя; двойная линия по периферии колонок - зона взаимного перекрывания Ув. х730. [26]
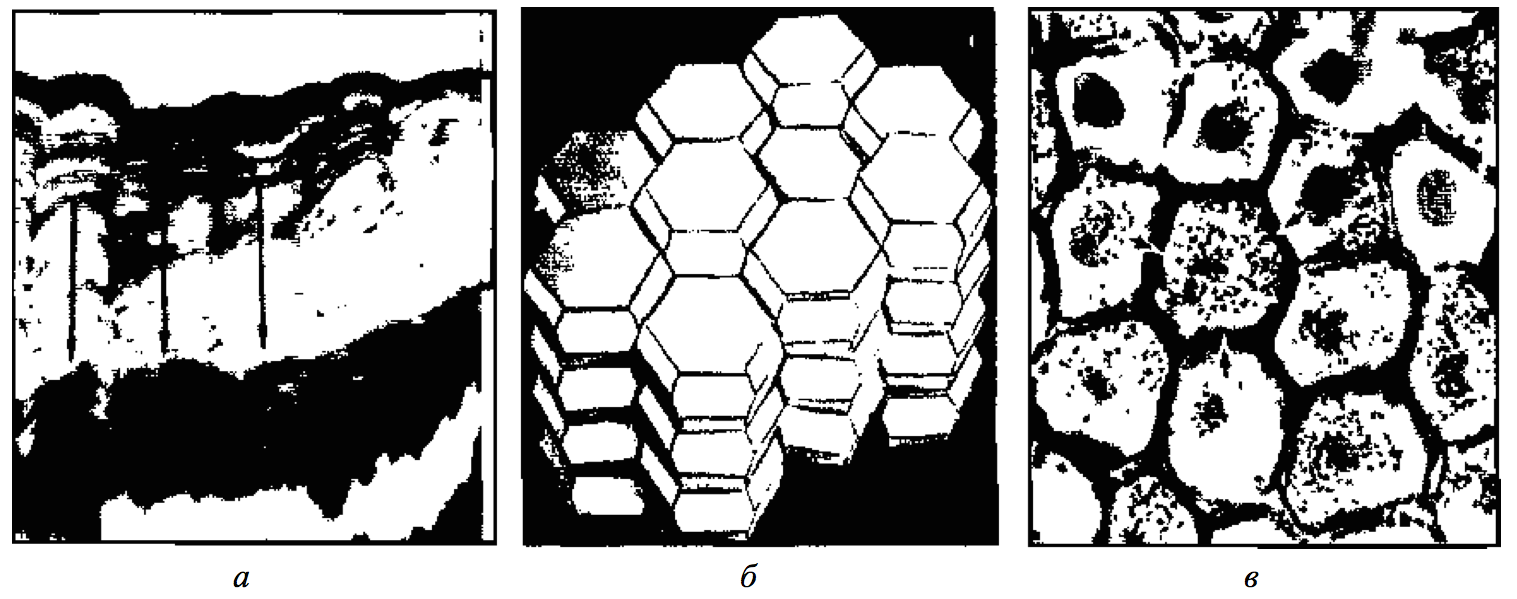
Механическая барьерная функция защиты от внешних воздействий (давление, ушибы, ссадины, колотые, рваные и резаные раны) обеспечивается плотным, благодаря тетрадекаэдрической упаковке клеток эпидермиса (Рис. 2), роговым слоем (особенно на ладонях и подошвах человека), эластичностью и механической резистентностью волокнистых структур соединительной ткани, буферными свойствами подкожной жировой клетчатки.
Толщина дермы различных участков тела человека возрастает в следующем по- рядке: лобок, палец, предплечье, подмышки, бедро, подошва, голень, плечо, грудь, лицо, спина, живот. У женщин и мужчин 26— 60 лет она варьирует в интервалах 634÷1930 и 857÷2584 мкм [68]. Толщина эпидермиса и дермы кожи — от 0,5 до 4 мм [65], кожи вместе с подкожной клетчаткой — от 2,5 до 6 мм [37]. Сравнительная интервальная оценка толщин соответствующих структурных слоев кожи млекопитающих подтверждает заключение о том, что контролируемые внутрикожные, подкожные и внутримышечные инъекции радионуклидов лабораторным животным моделируют колотые раны человека (Табл. 2) [12,27].
Таблица 2. Сравнительная морфометрическая характеристика кожи животных и человека [1,5,6,13,15,16,18, 20, 24, 57, 68]
| Толщина, мкм | Мышь | Крыса | Свинья | Человек |
| Эпидермиса | - | 30÷120 | 12,5÷100 | 18÷1094 |
| Дермы | 200÷300 | - | 1060÷2200 | 100÷2584 |
| Всей кожи | 750÷900 | 410÷1250 | 1000÷3000 | 500÷4000 |
При этом следует принимать во внимание степень васкуляризации раневого участка и глубину расположения в коже млекопитающих пяти кровеносных и двух лимфатических сетей сосудов. Поверхностная артериальная сеть располагается в основании сосочкового слоя дермы, глубокая артериальная — на границе подкожной клетчатки и дермы. Венозные сети представлены двумя поверхностными и одной глубокой сетью, которая состоит из 2-х сплетений и располагается в сетчатом слое дермы и в подкожной клетчатке [23]. Лимфатическая поверхностная сеть расположена ниже подсосочковых венозных сплетений и глубокая - в подкожной клетчатке.
Так через 0,5 ч после подкожного введения 241АmС13 крысам в хорошо васкуляризированную область хвоста общее резорбированное количество 241Аm составило 60% от количества введенного радионуклида. В печени, скелете, крови, мышцах и почках обнаружено 20,5; 5,9; 5,2; 4,0 и 2,1% соответственно [22], что в 40—200 раз (на два порядка) превышает данные при введении в область задней лапы, составляя соответственно, 0,21; 0,07; 0,05; 0,1; и 0,01% [12].
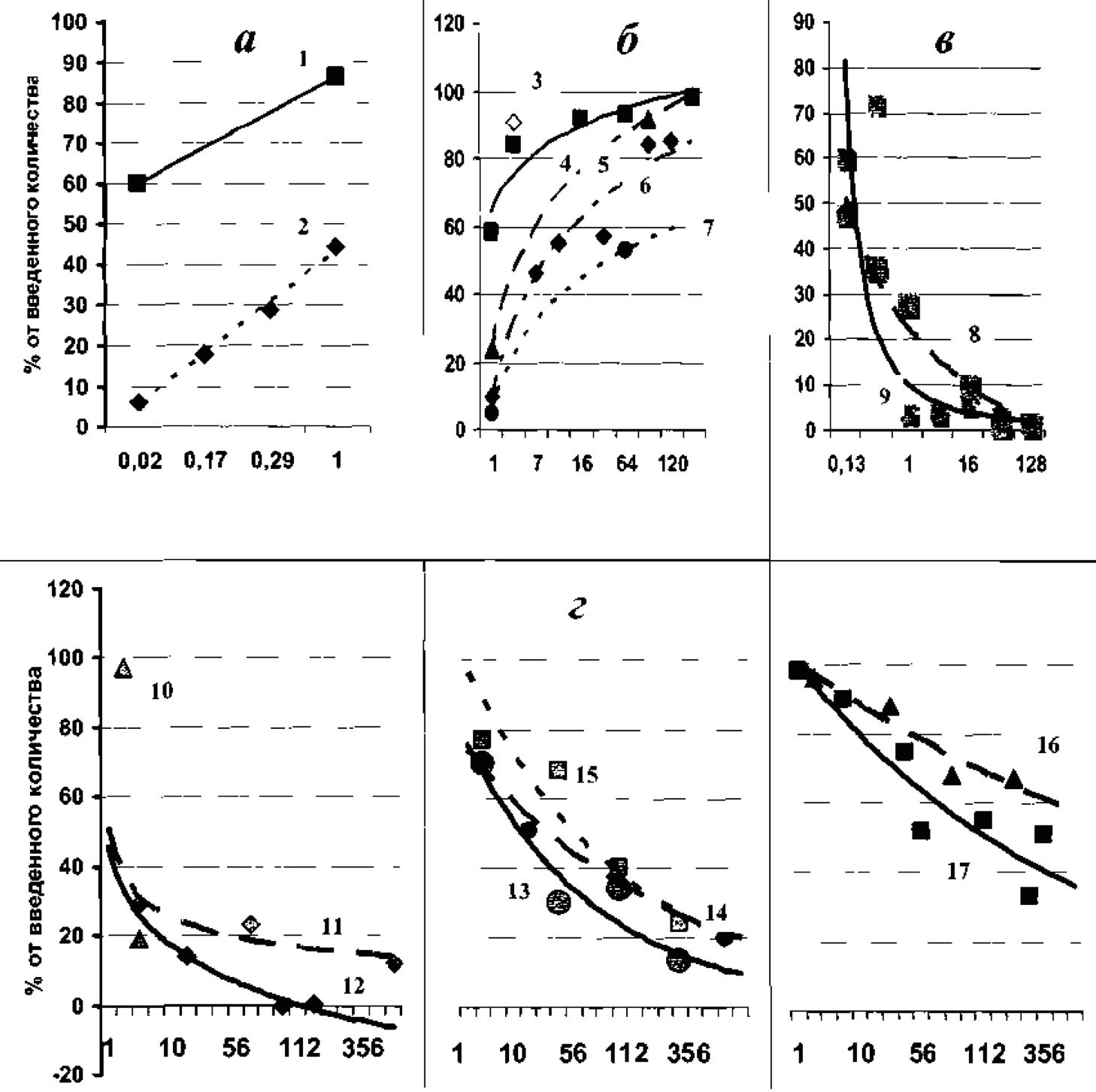
Через 24 часа после подкожной инъекции 241АmС13 в область задней лапы крыс всасывается 44,3% введенного радионуклида [12]. При введении 241АmС13 в область хвоста резорбция составила 86,5% т.е. в 2 раза выше, чем при введении в область задней лапы [22], (Рис. За).
Резорбция соединений Рu и Аm из контролируемых колотых ран
Опасность загрязнения ран радиоактивными веществами, кроме радиационного воздействия на ткани, развития патологического процесса и возникновения злокачественных новообразований в месте внутрикожной, подкожной (или внутримышечной) инъекции [3,29,50,52] определяется облучением внутренних органов и тканей от резорбированной доли радионуклида.
При экстраполяции данных о резорбции радионуклидов через раны животных на человека необходима оценка, как глубины и топографической локализации их раневого проникновения, так и физикохимических свойств радиоизотопа [11].
Скорость всасывания 241Аm (Рис. 3б) и 239Рu (Рис. Зг) из мышечной ткани зависит от физико-химической формы его соединения. Резорбция 241Аm (III) за первые 4 суток после внутримышечной инъекции крысам растворов, содержащих 0,4—5% цитрата натрия, составила 97% [34], цитрата 241Аm за 3 суток — 91% от введенного количества [10]. Близкие данные о всасывании цитратных комплексов 241Аm из мышечной ткани получены и в опытах на других видах животных: у мышей — 98—99% [61], у обезьян - 98,4% [33].
Резорбция 241АmС13, 241Аm(SO4)3, 241Аm(NO3)3, 241Аm(ОН)3 за 1 сутки у крыс составила, 58, 24; 10 и 4,7% от внутримышечно введенного количества, соответственно [12,35].
Через сутки после внутримышечной инъекции в область задней лапы крысам 241АmС13 (рН≈3,0) в печени и скелете обнаружено 11,7% и 6,4% от количества введенного радионуклида. Максимальное, накопленное в основных органах депонирования количество 241Аm приходится: в печени на 4-е сутки (24,2%), в скелете — на 32-е сутки (24,5%). На 4-8-е сутки в месте инъекции содержалось 31—32 введенного количества 241Аm, что соответствует уровню резорбции 69—68%.
При внутримышечной инъекции гидроокиси 241Аm наблюдается более низкое (в 4—5 раз в первые 4 суток после введения) содержание америция в органах. Как и при введении хлорида америция, максимальное содержание нуклида в печени наблюдается на 4-е сутки (5,1%) после введения гидроокиси америция, а в скелете - на 64-е сутки (9,6%). В месте введения, являющимся депо 241Аm в организме, на 64-е сутки содержится 46,7+5,2% введенного количества [12].
На 1-е и 7-е сутки у поросят в месте внутрикожной инъекции азотнокислого 239Рu обнаруживается 75—84 и 40—55% введенного количества. К концу первых суток в печени содержится в 2,5—4,5 раза больше 239Рu, чем в скелете [29].
Из подкожной жировой клетчатки (Рис. Зв) более интенсивно всасывается лимоннокислый 239Рu. Через 6 часов у поросят на месте инъекции остается 36% лимоннокислого 239Рu и 72,4% 239Рu-пентакарбоната аммония (введенного в избытке карбоната). Через 64 и 128 суток ~ 1,3 и менее 3% введенных количеств, соответственно. Всасывание 239Рu (NO3)4 из подкожной клетчатки у человека составляет порядка 3,5% за 4 часа экспозиции [4].
Рис. 3.
Резорбированное количество 241Am после однократной подкожной инъекции AmC13 (а): в область хвоста (■ - 1) [22], задней лапы (♦ - 2) [12] и резорбция при внутримышечном введении крысам (б): цитрата (◊ - 3), AmC13 (■ – 4), Am (SO4)3 (▲ – 5), Am (NO3)3 (♦ - 6), Am (OH)3 (● – 7) [10, 12, 35].
Содержание 239Pu в месте подкожной (в): инъекции лимоннокислого (+ - 8), Pu – пентакарбоната аммония поросятам (× - 9) [3, 12] и внутримышечного (г): введения [69]; Pu (IV) цитрата (Δ – 10), Pu (VI) цитрата крысам (◊ - 11) и собакам (♦ - 12); PuC13 (○ – 13), PuO2 (NO3)2 (● – 14), PuO2C12 (□ – 15); Pu (NO3)4 крысам (▲ – 16), Pu (NO3)4 кроликам (■ – 17).
 Время после введения, сутки Время после введения, сутки |
Наиболее интенсивно из мышечной ткани всасываются комплексные соединения 239Pu — цитрат (IV и VI-валентный) [69]. При введении крысам резорбция этих соединений достигает 70—80% за 7 суток (Рис. Зг). В последующий период резорбция замедляется и 239Pu длительно задерживается в месте введения (12% на 420 сутки). У собак на 103-и сутки на месте ведения цитрата определяются следы 239Pu (0,001%). По-видимому, видовые особенности оказывают определенное влияние на скорость всасывания 239Pu из мышечного депо [12]. При внутримышечном введении цитрата 238Pu (IV) обезьянам: через 20 часов в месте инъекции остаётся от 16 до 32% введённой активности радионуклида, и через 56 и 106 дней — от 1 до 3%, соответственно [36].
Всасывание хлористого 239PuO2С12 и азотнокислого 239PuO2(NO3)2 плутонила (VI- валентных) при внутримышечном введении составляет 30% за первые 4 суток. В дальнейшем наблюдается медленная резорбция 239Pu с постепенным снижением его содержания в месте введения. На 256- 406-е сутки в мышечной ткани обнаруживается 13- 20% введенного количества 239Pu. Хлористый III-валентный 239Pu(РuC13) из мышечной ткани всасывается примерно одинаково с VI валентным (РuO2С12).
Резорбция азотнокислого VI валентного 239 Pu из мышечной ткани происходит более медленно по сравнению с другими растворимыми соединениями. Через 256 суток после инъекции нитрата 239Pu крысам в месте введения обнаружено 67% первоначально инъецируемого количества. У кроликов через год после введения азотнокислого плутония обнаружено 51% введенного количества.
В первые 15 суток период полувыведения 239Pu (VI) из места инъекции составляет 6— 7,5 суток. 35—40% введенного количества, оставшегося на месте инъекции, выводится с полупериодом 184 суток. Период полувыведения хлористого 239Pu (III) из мышечной ткани составляет 117 суток, азотнокислого 239Pu (VI) — 495 суток [4]. 65÷96% резорбированного 239Pu (на 3—7 сутки после инъекции) задерживается в скелете.
Наблюдалась и чрезвычайно низкая резорбция цитрата Pu (VI) — 3% за 4 суток, доли, отложившиеся в скелете и печени, составили 30 и 26% [38]. А при внутримышечной инъекции крысам в икроножную мышцу мономерного нитрата 239Pu — высокая резорбция: через 3 суток в месте введения обнаружено только 35% от введенного количества, доли, отложившиеся в скелете и печени, составили 84 и 15% [10].
Уровень всасывания PuO2 объясняется размером частиц [12]. Обожженная двуокись плутония с размером частиц менее 0,7 мкм отличается более высокой подвижностью в колотой ране лапы собак, чем PuO2, с более крупным размером частиц [28]. При нанесении PuO2 на поврежденную кожу кроликов плутоний в кровяном русле не обнаружен [49]. Доказана возможность накопления плутония в органах при подкожной имплантации металлического плутония [53]. Резорбция за длительный период жизни кроликов (260—1048 суток) и у крыс (356—580 суток) составила 0,16-1,2 и 0,09—0,28%, соответственно.
Все растворимые соединения плутония и америция согласно классификации, использованной в публикации [31], отнесены к сильному виду удержания в ране (таблица 1). Однако, согласно параметрам классификации, для подкожного введения пентакарбоната аммония 239Pu наблюдается слабое, а лимоннокислого 239Pu - умеренное удержание [3], при внутримышечной инъекции азотнокислого 239Pu, нитрата и гидроокиси 241Am — сверхсильное удержание [12,35] (Рис. 3).
Выводы
- Вопрос применения моделей для описания поступления радионуклидов через поврежденную кожу человека остается открытым из-за трудностей определения исходной формы их нахождения в месте ранения.
- По скорости уменьшения всасывания 241Am из мышечной ткани растворимые соединения могут быть расположены в следующем порядке: Am – цитрат > AmC13 > Am (SO4)3 > Am (NO3)3 > Am (OH)3, а 239Pu, соответственно: Pu (IV) – цитрат > Pu (VI) – цитрат > PuO2C12 ≥ PuO2 (NO3)2 > PuC13 > Pu (NO3)4.
- Экстраполяция данных внутрикожных, подкожных и внутримышечных инъекций радиоактивных веществ лабораторным животным на человека предполагает оценку физико-химических свойств радионуклидов, глубины их раневого проникновения, локализации и васкуляризации раны, характера раневого процесса.
- При оценке уровней и скорости резорбции радионуклидов из колотых ран пострадавших при производственных инцидентах необходимо учитывать минимум три обстоятельства. Во-первых, вариабельность глубины раны и вероятность одномоментного загрязнения собственно кожи, подкожной жировой клетчатки и мышечной ткани. Во-вторых, степень васкуляризации места раневого канала и течение раневого процесса. И, в-третьих, изменчивость комбинаций и исходного физико-химического состояния радиоактивных веществ.
Литература
- Африканова Л.А. Острая лучевая травма кожи. Медицина, 1975, 192 с.
- Балабуха B.C., Фадкин Г.Е. Накопление радиоактивных элементов в организме и их выведение. М., Медгиз, 1958, 183 с.
- Булдаков Л.А., Нифатов А.П., Толочкова Н.М. Буров И.И., Всасывание плутония-239 через кожу и из подкожной клетчатки поросят. Радиобиология, 1967, т. 7, №4, с. 591-601.
- Булдаков Л.А., Любчанский Э.Р., Москалев Ю.И., Нифатов А.П. Проблемы токсикологии плутония. М., Атомиздат, 1969, 368 с.
- Грамматикати B.C. Дозиметрия при экспериментальных воздействиях на кожу длинноволнового рентгеновского и бета-излучения. — В кн.: Тезисы докладов на конференции «Воздействие ионизирующих излучений на кожу», М., 1970, с.39.
- Елисеев В.Г., Афанасьев Ю.И., Копаева Ю.Н., Юрина H.A. Гистология. Издание второе, исправленное и переработанное. М., Медицина, 1972, 616 с.
- Ильин Л.А., НорецТ.А., Швыдко Н.С., Иванов Е.В. Радиоактивные вещества и кожа. (Метаболизм и дезактивация). М., Атомиздат, 1972, 304 с.
- Иванников А.Т., Беляев И.К., Алтухова Г.А. Влияние способа введения пентацина на выведение из организма крыс 239Рu и 241Аm. - В сб.: Радиобиологический эксперимент и человек. Под ред проф. Ю.И. Москалева, М., 1986, с.74-78
- Ильин Л.А., Иванников А.Т., Попов Б.А. О переносе данных с животных на человека по метаболизму радиоактивных веществ при попадании их на раневую поверхность. Современные вопросы радиационной медицины и радиобиологии. Тезисы Всесоюзной научной конференции, М., 1975, с.170-171.
- Ильин Л.А., Иванников А.Т. Радиоактивные вещества и раны (Метаболизм и декорпорация), М.: Атомиздат, 1979, 256 с.
- Калантаевская К.Л. Морфология и физиология кожи человека. Киев, Здоровье, 1972, 266 с.
- Карташев H.H., Соколов В.E., Шилов И.А. Практикум по зоологии позвоночных, М., Аспект Пресс, 2004, 383 с.
- Лейли А.М. Анатомия и физиология кожи. — В кн.: Радиация и кожа. Пер. с англ. под ред. Д.П.Осанова. М., 1969, с.13- 21.
- Либерман А.Н., Бронштейн И.Э., Сафронов М.В. О путях переноса результатов экспериментальных исследований по обоснованию ПДУ облучения кожи. В кн.: От радиобиологического эксперимента к человеку. Под ред. Ю.И.Москалева, М., Атомиздат, 1976, с.31- 34.
- Маслюк А.И., Богданов И.М., Симоненко П.Д. Особенности формирования доз внутреннего облучения персонала плутониевого производства Сибирского химического комбината. Бюллетень сибирской медицины, 2005, №2, с.124— 127.
- Международная комиссия по радиологической защите. Публикация №23 (Человек. Медико-биологические данные). Пер. с англ. Ю.Д. Парфенова, М., Медицина, 1977, 496 с.
- Окладникова Н.Д., Хохряков В.В., Шевкунов В.А., Пестерникова B.C., Щадилов A. E., 239Pu: Клинико цитогенетическое наблюдение описания случая высокой, инкорпорации радионуклида (24 года наблюдения). Радиационная биология. Радиоэкология, 2004, т. 44, No 4, с.415-419.
- Осанов Д.П.,Клыков О.В.,Архипова Э.Э., Ершов Э.Б., Ракова В.А., Буров Н.М. Использование экспериментальных данных о проникновении радионуклидов через кожу животных при нормировании ПДУ загрязнения кожных покровов. В кн.: От радиобиологического эксперимента к человеку. Под ред. Ю.И.Москалева, М., Атомиздат, 1976, с.84-93.
- Степанов B.C., Заликин Г.А. Распределение и кинетика выведения америция- 241 из организма крысы. Радиобиология, 1970, т. 10, вып.1, с.150.
- Хлыстова З.С., Шергин Н.П., Преображенский Н.М. Кожа. Ветеринарная энциклопедия. Изд-во Советская энциклопедия, М., 1972, т,3, с.461-469.
- Хохряков В.Ф., Кудрявцева Т.Н., Шевкунов В.А. Риск поступления плутония и 241Аm в организм работников радиохимического предприятия через травмированную кожу. Атомная энергия. 1994, т. 77, вып. 6, с. 445—448.
- Хохряков В.В., Хохряков В.Ф.,Суслова К.Г., Ефимов A.B., Востротин В.В., Щадилов А.Е. Состояние и перспективы развития дозиметрии внутреннего облучения персонала ПО «Маяк», Вопросы радиационной безопасности, 2004, №3, с. 25-40.
- Хэм А., Кормак Д. Гистология. Пер. с англ. Мир, 1983, т.4, 245 с.
- Швыдко Н.С., Рушоник С.И. Преимущество профилактического использования препарата железа для модификции обмена плутония-239 при его раневом поступлении. Актуальные вопросы радиационной гигиены. Тезисы докладов Всесоюзной конференции, г. Обнинск 15-16 октября 1987 года, М., 1987, с.102-103.
- Bistline R. W., Walters R. L., Lebel J. L. A study of translocation dynamics of plutonium and americium from simulated puncture wounds in beagle dogs. Health Phys., 1972, V. 22, №6, p. 829-831.
- Cable J. W, Horstman V. G., Clarke W. J. Bustad L. K. Effects of intradermal injections of plutonium in swine. Health Phys., 1962, v. 8, p. 629-634.
- Dagle, G.E., Lebel, J.L., Phemister, R.D., Walters, R.L., Gomez, L.S. Translocation kinetics of plutonium oxide from the popliteal lymph nodes of beagles. Health Phys. 1975, v. 28, p.395-398.
- Dagle G.E., Bristline R.W., Lebel J.L., Walters R.L. Plutonium-induced wounds in beagles. Health Phys., 1984, v. 47, p.73-84.
- Development of a biokinetic model for radionuclide-contaminated wounds and procedures for their assessment, dosimetry and treatment: recommendation of the Nationale Counsil on Radiation Protection and Measurements / NCRP report №156, NCRP 2007,411р.
- Durbin P. W. Distribution of the transuranic elements in mammals. Health Phys., 1962, v. 8, p. 665-671.
- Durbin P. W., Jeung N., Williams М. H. Dynamics of 241Am in the skeleton of the rat: A study of the relationship between behavior of bone-seeking elements and bone-growth status.-ln: Delayed effects of bone-seeking radionuclides, Salt Zake City, University of Utah Press 1967, p. 137-156.
- Durbin P. W. Metabolism and Biological Effects of the Transplutonium Elements. In: Uranium, Plutonium, Transplutonic elements. Ed. H. C. Hodge, J. H. Stannard, J. B. Hursh. Berlin -Heidelberg - New York, Springer Verlag, 1973, p. 739-908.
- Durbin P.W., Jeung N., Schmidt C.T. 238Pu (IV) in monkeys', overview of metabolism / U.S. Nuclear Regulatory Commission Report, 1985, № NUREG/ CR-4355, v.1 LBL-20022.
- Eisner R. W. Skinfold Thickness in Primitive Peoples Native to Cold Climates. Ann. New York Acad. Sei., 1963, v. 110, p. 503-514.
- Foreman H. Medical management of radioactivity contaminated wounds. In: Diagnosis and Treatment radioactive Poisoning.Vienna, IAEA, 1963, p. 387- 411.
- Hammond S.E., Putzier E.A. Observed effects of plutonium in wounds over a long period of time. Health Phys., 1964, v. 10, №6, p. 399-406.
- Harrison, J.D., David, A.J., Stather, J.W. Experimental studies of the translocation of plutonium from simulated wound sites in the rat. Int. J. Radiat. Biol., 1978, v. 33, p.457-472.
- Jech J.J., Andersen B.V., Heid K.R. InterpretationofHumanUrinary Excretion of Plutonium for Cases Treatment with DTPA. Health Phys., 1972, v. 22 (June), p. 787-792.
- Johnson L. J. Retention of subcutaneously placed Pu02 in the beagle. Health Phys., 1970, v. 19, N2, p. 337-338.
- Johnson L.J., Walters, R.L., Lagerquist, C.R., Hammond, S.E. Relative distribution of plutonium and americium following experimental PuO2 implants. Health Phys., 1970, v. 19, p.743-749.
- Johnson L. J., Lawrence J.N. P. Plutonium contaminated wound experience and assay techniques at the Los Alamos Scientific Laboratory. Health Phys., 1974, v. 27, №1, p. 55-59.
- Jolly L., McClearen H.A., Poda G.A., Walke W.P. Treatment and Evaluation of Plutonium-238 Nitrate Contaminated Puncture Wound. A Two-Year Case History. Health Phys., 1972, v. 23(Sept.), p. 333-341.
- Khokhryakov V.F., Belyaev A.P., Kudravtseva T.I., Schadilov A.E., Moroz G., Shalaginov V.A. Successful DTPA Therapy in the Case of 239Pu Penetration Via Injured Skin Exposed to Nitric Acid. Radiation Protection Dosimetry, 2003, v. 105(1-4), p. 499-502.
- Lagerquist C.R., Hammond S.E., Putzier A.E., Piltingsrud C.W. Effectiveness of early DTPA treatments in two types of plutonium exposures in humans. Health Phys., 1965, v. 1, p. 1177-1180.
- Lagerquist C.R., Allen I.B., Holman, K.L. Plutonium Excretion Following Contaminated Acid Bums and Prompt DTP A Treatments. Health Phys., 1967, v. 13(1), p. 1-4.
- Langham W. H. Physiology and Toxicology of plutonium-239 industrial medical control. Health Phys., 1959, v. 2, №9, p. 172-185.
- Langham W. H., Lawrence J. W. P., McClilland W. H., Hempelman L. A. The Los Alamos Scientific Laboratory Experience with plutonium in man. Health Phys., 1962, v. 8, p. 753-760.
- Leggett R. W., Eckerman K.F., Khokhryakov V.F., Suslova K.G., Krahenbuhi M.P ., Miller S.C. Mayak worker study: An improved biokinetic model for reconstructing doses from internally deposited plutonium. Radiation Research., 2005, v. 164(2), p. 111-122.
- Lisco H., Finkei M. P., Brues A. M. Carcinogenic properties of radioactive fission products and of plutonium. Radiology, 1947, v. 49, p. 361-363.
- Lisco H., Kisieleski W. E. The fate and pathological effects of plutonium metal implanted in to rabbits and rats. Amer. J. Path., 1953, v. 29, p. 305-321.
- Mays C.W., Taylor G.N., Lloyd R.D., McFarland S.S., Fisher D.R., Calder S.E., Boseman J.J. DTPA Research at the University of Utah. Proceeding of the 4th International Congress of the International Protection Association, Paris, France, 1977, v. 4, p. 1211-1214.
- Métivier H., Masse R., Durbin P. W., Raymond K. N. Promotion by tetrameric catechoylamide ligands and CaNa3- DTP A of the dissociation in vitro of the Pu-transferrin complex formed after intravenous injection of Pu-tri-N- butylphosphate. Health Phys., 1985, v.49, p.1302-1305.
- Morin M., Nénot J. C., Lafuma J. The Behavior of 237Np in the Rat. Health Phys., 1973, v. 24, p. 311-315.
- Murray J.L. Thyroid uptake of 1311 from skin exposure. In: Yanford Biology Research annual Reports for 1964. Edited by R.C.Thompson, S.W.Woods. Wahington, Pacific Northuest Laboratory Richland, 1965, p.55-58.
- Nénot J.C., Morin M., Lafuma J. Étude métabolique et thérapeutique des contaminations respiratories par certains actinides en solution. Health Phys., 1971, v. 20(2), p. 167-177.
- Newton D., Wells A.C., Mizushita S., Toohey R.E., Sha J.Y., Jones R., Jefferies S.J., Palmer H.E., Rieksts G.A., Anderson A.L., Campbell G.W. The Livermore phantom as a calibration standard in the assessment of plutonium in lungs. Harwell: Environmental and Medical Sciences Division, AERE Harwell; Report № AERE- R-11210, 1984.
- Ohlenschlager L., Schieferdecker H., Schidt- Martin W. Efficacy of Zn- DTPA and Ca- DTP A in Removing Plutonium from the Human Body. Health Phys., 1978, v. 35 (Nov), p.694-699.
- Parker H. G., Low-Beer A. de G., Isaac E. L. Comparison ofretention and organ distribution of 241Am and 252Cf in mice: The effect of in vivo DTPA chelaton. Health Phys., 1962, v. 8, p. 679-684.
- Parker H.M. Plutonium, Industrial Hygiene, Health Physics, and related Aspect. In:Uraniun
- Piechowski J., Cavadore D., T ourte J., Caurguil M. H., Raunaud P., Harduin J. C., Thomas P . and Chaptinel. Model and practical information concerning the radiotoxicological assessment of a wound contaminated by plutonium. Radiation Protection Dosimetry, 1989, v. 26 (1), p.265-270.
- Planas-Bohne F ., Ebel H. Dependence of DTP A-Toxicity on the Treatment Schedule. Health Phys., 1975, v. 29 (July), p.103-106.
- Rushmer R. F., Buettner K. J. K., Shart J. M., Ödland G. F. The Skin. Science, 1966,v. 154, p. 343-348.
- Schofield G.B. Absorption and measurement of radionuclides in wound and abrasion. Clin. Rad., 1963, v. 15(1), p. 50-54.
- Schofield G. B. Comparison in the medical management of three cares of plutonium contaminated wounds. In: Handling of Radiation Accidents. Proc. Symposium Vienna, 19-23 May 1969, p. 163-172.
- Southwood W. F. W. The Thickness of the Skin. Plast. Reconst. Surg., 1955, v. 15, p. 423-429.
- Vaughan J. Ch. Metabolism of 239Pu with special Reference to the Skeleton. In: Uranium, Plutonium, Transplutonic elements. Ed. H. C. Hodge, J. N. Stannard, J. B. Hursh. Berlin — Heidelberg-New York, Springer Verlag, 1973, p. 351-391.


